第14讲 新情境下的方程式书写
【教学目的】
1、 通过非氧化还原反应的书写,了解反应的规律,学会判断反应的产物,从而掌握配平的技巧。
2、 通过氧化还原反应方程式的书写,了解反应的规律,正确判断氧化产物和还原产物,根据得失电守恒,从而掌握配平的方法。
3、通过离子反应方程式的书写,了解反应的实质,正确判断反应的产物,根据离子反应电荷守恒,从而掌握配平的方法。
【教学重难点】
离子反应的氧化还原方程式的配平
【授课方法】
讲授与课堂练习相结合

【教学内容】
考点一、陌生非氧化还原反应类方程式的书写
1、(2018江苏小高考)高温分解Si(CH3)2Cl2也可以制得SiC,同时还生成CH-4和一种酸性
气体,写出应该反应的化学方程式: 。
2、工业上以SiCl4、N2、H2为原料,在高温下反应生成氮化硅和一种酸性气体,写出该反应
的化学方程式: 。
3、(2015江苏小高考)水煤气中CO和H2在加热、加压、催化剂存在条件下可以合成液体
燃烧甲醇(CH3OH),该反应的方程式为: 。
![]() 【针对训练】(1)CO2 + H2 CH3CH2OH
【针对训练】(1)CO2 + H2 CH3CH2OH
![]() (2)CO + H2 CH3CH2OH
(2)CO + H2 CH3CH2OH
![]() (3)CO2 + H2 CH4
(3)CO2 + H2 CH4
![]() (4)CO2 + H2 C5H12
(4)CO2 + H2 C5H12
4、金红石(TiO2)、碳粉混合,在高温下通入Cl2得到TiCl4 和一种可燃性气体,该反应的化
![]() 学方程式为: TiO2 + C + Cl2 TiCl4
学方程式为: TiO2 + C + Cl2 TiCl4
5、氮化铝可以由Al2O3、N2和过量碳粉混合在一定条件下制得,写出反应的方程式:
![]() Al2O3 + N2 + C
Al2O3 + N2 + C
6、氢氟酸雕刻玻璃:
![]() 7、Mg3N2 + HCl
7、Mg3N2 + HCl
8、氮化硅陶瓷抗腐蚀能力强,除氢氟酸外不和其它酸反应, 写出氢氟酸腐蚀的化学方程式:
9、A是由两种短周期元素组成的物质,其摩尔质量为144g/mol,B是最简单的烃,C是白色胶状沉淀,写出A与水反应的方程式:
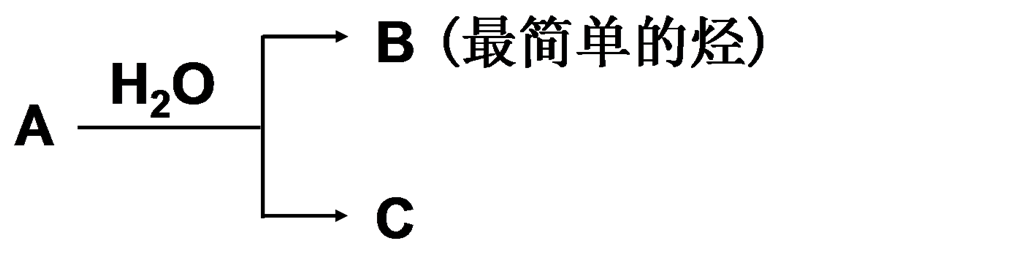 | |
10、(2016江苏小高考)某胃药主要成分的化学式为Al2Mg6(OH)16CO3,常用于治疗胃酸过多,写出胃酸反应的化学方程式:
![]() Al2Mg6(OH)16CO3 + HCl
Al2Mg6(OH)16CO3 + HCl
【针对训练】
(1)胃药达喜(铝碳酸镁:Al2Mg6CO3(OH)16·4H2O )中和胃酸的离子反应式:
![]() Al2Mg6CO3(OH)16·4H2O + H+
Al2Mg6CO3(OH)16·4H2O + H+
(2)AlaMgb(OH)cCO3中和胃酸的化学反应方程式:
![]() AlaMgb(OH)cCO3 + HCl
AlaMgb(OH)cCO3 + HCl
(3)三硅酸镁(2MgO·3SiO2·nH2O)与胃酸反应生成
![]() ① 胶状的SiO2 2MgO·3SiO2·nH2O + HCl
① 胶状的SiO2 2MgO·3SiO2·nH2O + HCl
![]() ② SiO2·H2O 2MgO·3SiO2·nH2O + HCl
② SiO2·H2O 2MgO·3SiO2·nH2O + HCl
![]() ③ H2SiO3 2MgO·3SiO2·nH2O + HCl
③ H2SiO3 2MgO·3SiO2·nH2O + HCl
11、MgCl2·6H2O受热分解生成Mg(OH)Cl,写出其受热分解的化学方程式:
![]() MgCl2·6H2O
MgCl2·6H2O
12、在海洋碳循环中,可通过下图所示的途径固碳。写出钙化作用的离子方程式:
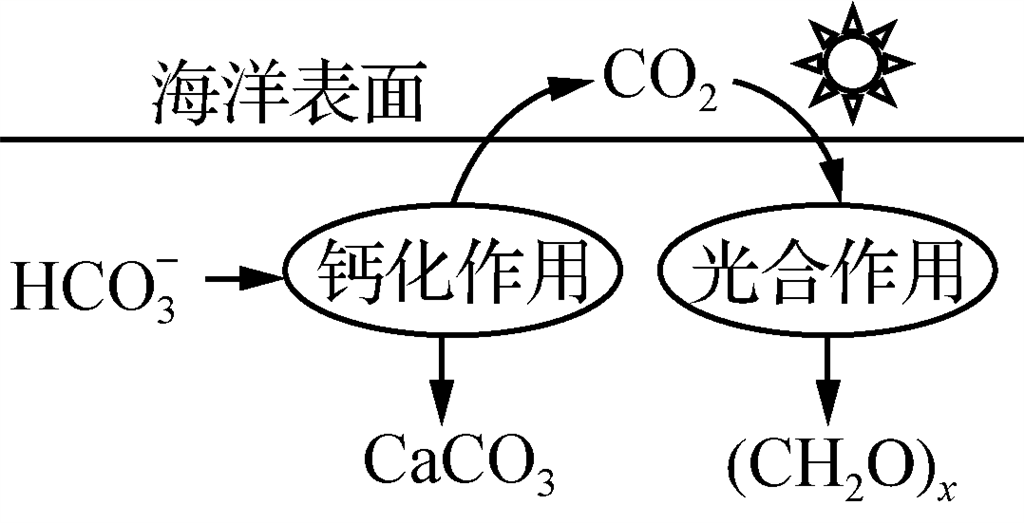
考点二、陌生氧化还原反应类方程式的书写
氧化产物和还原产物的确定
氧化剂 | Cl2 | O2 | 浓H2SO4 | 浓HNO3 | 稀HNO3 | H2O2 | Fe3+ | KMnO4(H+) | KClO3 | ClO- | ||
还原产物 | ||||||||||||
还原剂 | I- | S2- | CO、C | Fe2+ | NH3 | SO2 | H2O2 | |||||
氧化产物 | ||||||||||||
![]() 例如:(1) NH3 + O2 N2 + H2O
例如:(1) NH3 + O2 N2 + H2O
![]() (2) NH3 + CuO
(2) NH3 + CuO
![]() (3) NH3(足量)+ Cl2
(3) NH3(足量)+ Cl2
![]() (4) CH4 + CuO
(4) CH4 + CuO
反应下列反应的方程式
1、NO2 与 SO2通入水中 NO2 + SO2
2、酸性条件下,Fe2+ 溶液中加入H2O2 Fe2+ + H2O2
3、酸性条件下,H2O2溶液中加入Cu粉 Cu + H2O2
4、酸性条件下,Fe3+ 氧化SO2 Fe3+ + SO2
5、酸性条件下,Fe3+ 氧化SO32- Fe3+ + SO32-
6、硫在碱性条件下生成Na2SO3 S + NaOH
![]() 7、亚硝酸很不稳定,分解生成NO和一种强酸 HNO2 NO
7、亚硝酸很不稳定,分解生成NO和一种强酸 HNO2 NO
8、污水处理的方法很多,如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中能入Cl2,上将CN- 氧化为无毒的N2和CO2,使水质得到净化,写出应该反应的离子方程式。
![]() CN- + Cl2 N2 + CO2
CN- + Cl2 N2 + CO2
【教学反思】
新课程的实施,教师面对的不仅是新的教材,更重要的是新的课程理念。新课程的核心理念之一就是使学生真正成为课堂的主人,在快乐中学习,在体验中成长,并结合学生的实际情况去创设教学情境。故本人对本节课课后有如下反思:
1.选材适宜 引课朴素
学生生活在这个由化学物质组成的世界里,身边发生的许多现象都是化学反应的结果,生活已经给他们提供了一些经验。贴近生活实际的问题对学生来说有很强的吸引力,往往使他们自觉的去探讨和实践。学生最感兴趣的问题是最有驱动性的,因此,在选取素材设计具体探究问题时要充分关注学生的兴趣所在。
2.合理搭台 探究有度
设计的探究问题不能跨度过大,应符合学生的已有知识和经验。适当的搭台阶、做铺垫,能使学生积极主动参与、亲身实践,成为实践活动和认知活动有目的的承担者,使学生成为一件轻松愉快的事情。本节课在讲氧化还原反应方程式书写的时候,由浅入深,由易到难,探究有度,符合学生的认知规律,体现了以人为本的教学理念。
3.不足之处
教学的内容过多,使学生的学习过程稍显局促,学生的思维空间有所压缩,在以后的教学中应更好的了解的学生的情况,做到有的放矢。