溶液中离子浓度比较
【教学目标】
1、能有效识别水溶液体系中的各类问题,形成分析水溶液问题的整体思路,面对陌生或者复杂的水溶液问题,能有清晰的分析思路。
2、能主动利用化学平衡思想解决复杂的水溶液问题,具备基本的分析思路。
3、面对电离平衡和水解平衡共存的溶液,能依据信息或实验事实判断“电离”和“水解”
的主次。
 【教学过程】
【教学过程】
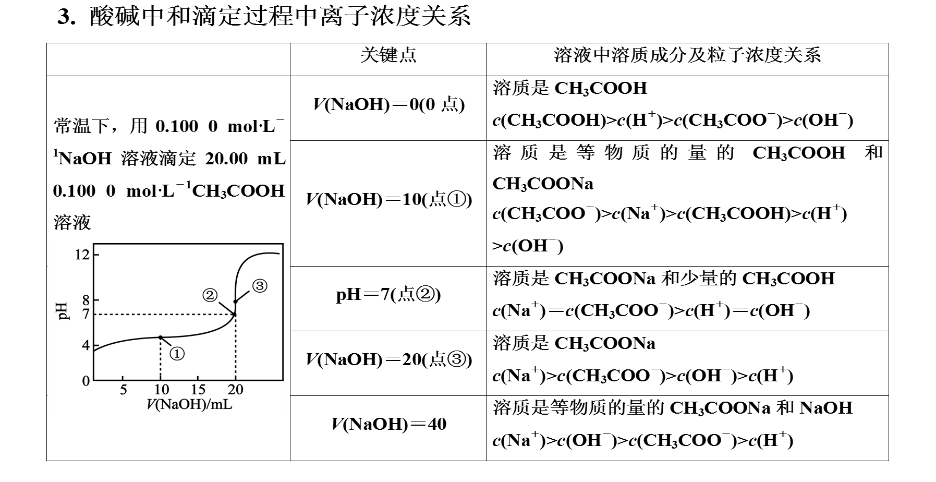
环节一:试试看:请大家写出0,①, ②,③四点的微粒浓度大小关系。
环节二:
例1下列说法是否正确
1、 [2014·江苏高考14 ] D.0.1 mol·L-1 Na2C2O4溶液和0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-) + c(HC2O4-) + c(OH-) = c(Na+) + c(H +)
2、[2015·江苏高考14 ] A.室温下,向0.10mol·L-1NH4HCO3溶液中通入CO2至溶液pH=7:c(NH4+)=c(HCO3-)+c(CO32-)
3、 [2014·江苏高考14 ] C.0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液等体积混合:2c(Na+) =3 c(CO32-) + 3c(HCO3-) + 3c(H2CO3)
4 、[2015·江苏高考14 ] C.室温下, 0.10mol·L-1Na2SO3溶液通入SO2至溶液pH=7 :
c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
5 、[2014·江苏高考14 ] B.0.1 mol·L-1 NH4Cl溶液和0.1 mol·L-1 氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
6、[2017·江苏高考14] D.0.2 mol?L﹣1 CH3COONa 与 0.1 mol?L﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO﹣)>c(Cl﹣)>c(CH3COOH)>c(H+)
7、[2017·江苏高考14 ] C. 0.2 mol?L﹣1 HCOOH 与 0.1 mol?L﹣1 NaOH 等体积混合后的溶液中:c(HCOO﹣)+c(OH﹣)=c(HCOOH)+c(H+)
8、 [2015·江苏高考14 ] B.室温下,向0.10mol·L-1NaHSO3溶液中通入NH3至溶液pH=7 :
c(Na+)>c(NH4+)>c(SO32-)
9、 [2015·江苏高考14 ] D.室温下, 0.10mol·L -1CH3COONa溶液中通入HCl至溶液pH=7 :c(Na+)>c(CH3COOH)=c(Cl-)
 环节三:
环节三:
解题策略
? 1、写出电离平衡、水解平衡方程式或反应方程式
? 2、分析溶液微粒
? 3、找到相应守恒模型
? 4、熟悉三大守恒运用
? 一边阳离子,一边阴离子;中性----电荷守恒
? 一边一种元素,一边另一种元素;原始物料----物料守恒
无明显特征-----电荷、物料守恒联立消去题设不含的微粒
环节四:练一练 1、[2018·江苏高考] .H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10?2,Ka2 (H2C2O4 ) =5.4×10?5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4?) +c(C2O42?)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L?1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1000 mol·L?1 H2C2O4溶液:c(H+ ) =0.1000 mol·L?1+c(C2O42? )+c(OH?)?c(H2C2O4 )
B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42? ) >c(H+ )
C.pH = 7的溶液:c(Na+ ) =0.1000 mol·L?1+ c(C2O42?) ?c(H2C2O4)
D.c(Na+ ) =2c(总)的溶液:c(OH?) ?c(H+) = 2c(H2C2O4) +c(HC2O4?)
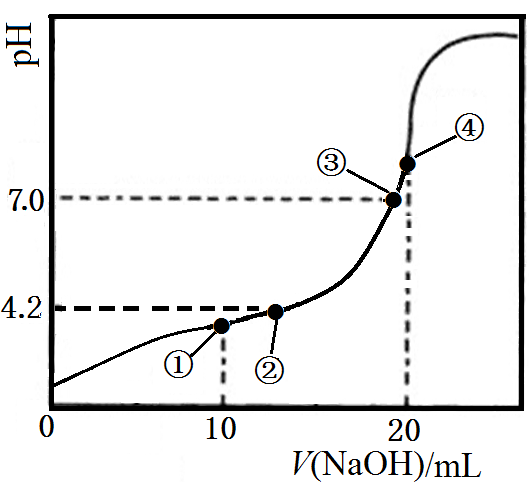 2、[2018·苏北四市一模] 14.常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是
2、[2018·苏北四市一模] 14.常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:
c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B.点②所示溶液中:c(HC2O4-)=c(C2O42-)
C.点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D.点④所示溶液中: c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
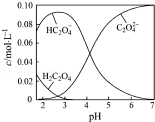 3、[2016?江苏高考] H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100mol?L﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
3、[2016?江苏高考] H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100mol?L﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.pH=2.5的溶液中:
c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣)
B.c(Na+)=0.100 mol?L﹣1的溶液中:
c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣)
C.c(HC2O4﹣)=c(C2O42﹣)的溶液中:
c(Na+)>0.100 mol?L﹣1+c(HC2O4﹣)
D.pH=7的溶液中:c(Na+)>2c(C2O42﹣)
 【教学反思】
【教学反思】
新高考模式下,选修越来越被弱化,化学复习阶段时间紧、任务重,如何提高总复习的效率,做到在短时间内培养能力、提高素质, “微专题”是一突破口。
本节课采用的“微专题”复习模式是范例式教学模式。所谓范例式教学就是从个别到一般,从具体到抽象的过程,在教学中一般从一些范例分析入手感知原理与规律,并逐步提炼进行归纳总结,再进行迁移整合。范例教学模式比较适合原理、规律性的知识。
![]()
![]()
![]()
![]() 本节课设计的教学流程为:阐明“个”案 范例性阐明“类”案 范例性地掌握规律原理 掌握规律原理的方法论意义 规律原理运用训练。
本节课设计的教学流程为:阐明“个”案 范例性阐明“类”案 范例性地掌握规律原理 掌握规律原理的方法论意义 规律原理运用训练。
水溶液复习教学前后学生的认识表现:
认识发展点 | 教学前学生的认识表现 | 教学后应达到的认识表现 |
微粒间的相互作用 | 能分析常见离子反应,但不能主动 利用沉淀反应、酸碱反应、氧化还原反应、电离平衡和水解平衡分析陌生情景的水溶液问题 | 能全面地认识水溶液中存在的各种微粒之间相互作用 的种类,能主动从微粒间相互作用的角度分析陌生情景的水溶液问题 |
水溶液的分析思路 | 能处理简单离子反应和离子平衡问题,但对不同题目分析思路不相同。 面对陌生或者复杂的水溶液问题,缺乏思路或者思路混乱 | 能有效识别水溶液体系中的各类问题,形成分析水溶 液问题的整体思路,面对陌 生或者复杂的水溶液问题,能有清晰的分析思路 |
平衡思想和分析水溶液中平衡问题的基本思路 | 能用 “平衡”思想分别分析电离平 衡、水解平衡等各类“平衡”问题。但不能主动将电离平衡、水解平衡建立联系,缺少“平衡”问题的基本分析思路 | 能将水溶液中的电离平衡、水解平衡视为类似的可逆过程,能主动利用化学平衡思想解决复杂的水溶液问题, 具备基本的分析思路 |
多种平衡共存时,主次分析 | 能准确识别溶液中存在电离平衡和水解平衡,但面对电离平衡和水解平衡共存的溶液,缺少分析思路 | 面对电离平衡和水解平衡共存的溶液,能依据信息或 实验事实判断“电离”和“水解”的主次 |