《平衡原理在原电池中的应用》课后反思
接到

于是我就在历年全国各地的高考题中找相应的高考题,看能否把原电池的知识和其他知识点结合起来的。终于在12年福建省的高考题中找到这么一道题目:
控制适合的条件,将反应2Fe3++2I- ![]()
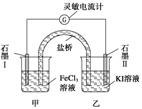
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
找到这道题目,我的课题基本上可确定了,将平衡原理和原电池结合起来。但是自己心里也犯嘀咕,这个反应真的是可逆的吗?逆向设计原电池真的会有电流产生吗?

在实验室,准备好相关的药品,开始做相应的实验。一开始的时候,怎么做这个实验,电流计指针的偏转都和我预想的是相反的,这让我很沮丧,也分析不出原因。实验员
最后,整堂课上完,自我感觉有这么几点遗憾:
1、 课堂的节奏略嫌慢了一些,以致后来的课堂当堂训练不够
2、 毕竟是高三的复习课,整堂课虽然整合了部分学科内的知识点,但是感觉知识的难度系数不够高,高度略嫌不够
3、 这些实验如果设计成学生实验,也许学生对知识的理解会更直观一些,但局限于实验室的条件不够,这也是一个遗憾
4、 如果准备得再充分一些,对知识能挖掘得更深入一些,整堂课可以体现得更丰满一些
